![]() MISE À JOUR SUR LA LA PHOTOTHÉRAPIE
MISE À JOUR SUR LA LA PHOTOTHÉRAPIE
|
Par
Centre
Hospitalier de l’Université de Montréal LA PHOTOTHÉRAPIE
La photothérapie (du grec: phôs, phôtos,
lumière; therapeia, traitement) consiste à traiter le psoriasis et une vaste
gamme d’affections cutanées au moyen de radiations électromagnétiques non
ionisantes, telles que les rayons ultraviolets (UV). Ce traitement médical,
qu’il soit de source naturelle
ou artificielle, suppose le respect d’un certain nombre de conditions, et
plus spécialement une surveillance médicale étroite à cause des accidents
sérieux qu’il peut provoquer..
L’HÉLIOTHÉRAPIE
L’héliothérapie consiste à exposer le corps en entier ou en partie aux
rayons du soleil. L‘héliothérapie a connu par le passé une grande vogue
lorsque la pharmacopée était bien restreinte.
Le rôle que
joue le soleil dans l'amélioration de certaines maladies cutanées telle que
le psoriais était connu depuis des millénaires. Dans le passé
l’héliothérapie était surtout recommandée,
dans les cas de certaines carences vitaminiques (rachitisme chez
l’enfant, par exemple), de certaines formes de tuberculose non pulmonaire
(osseuse en particulier), ou pour accélérer le processus réparateur des
maladies cutanées. A ces bienfaits objectifs viennent s’ajouter des effets
psychologiques bénéfiques. LA MER MORTEL’endroit géographique par excellence pour traiter le psoriasis
n’est nul autre que la Mer Morte. considérée comme le sous-sol de notre
planète. Aristote (304-322 avant JC) fut le premier à en consigner les
qualités étonnantes, "de l'eau très amère et salée, dans laquelle aucun
poisson ne peut vivre et aucun homme ou animal ne peut s'y noyer".
La Mer Morte occupe une
surface de 80 x 17 km et comporte deux bassins: un au nord - 350 m de
profondeur - et le second au sud, d'à peine quelques mètres de profondeur.
Elle est située dans un bassin encaissé entre des montagnes s'élevant à 1200
m au-dessus de sa surface. Les températures y sont élevées toute l'année. Sa
situation privilégiée à environ 400 mètres au dessous du niveau de la mer,
contribue au développement d'un climat unique du fait qu'à cette basse
altitude une couche atmosphérique additionnelle est présente. Celle-ci, en
association avec la brume d'évaporation, forme un filtre naturel qui bloque
la portion érythématogène des UVB <300nm et d'ailleurs inutile pour le
psoriasis, et permet le passage des UVB >300nm, reconnus pour leurs
propriétés thérapeutiques à enrayer le psoriasis.
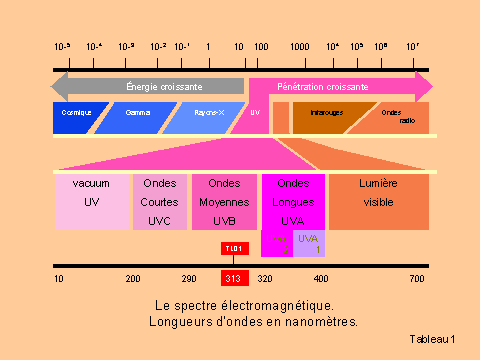
LE RAYONNEMENT SOLAIRELe spectre
solaire est composé de trois familles de longueurs d'ondes: les
ultraviolets, la lumière visible et les infrarouges. Les ultraviolets étant
des rayons invisibles, le terme radiation plutôt que lumière serait plus
approprié. On reconnaît
trois groupes de rayons ultraviolets : Les UVA, les UVB et les UVC. Les UVA: ont
d’une longueur d’onde comprise entre 320 et 400 nm. À leur tour, ils se subdivisent en : UVA1 (340 - 400
nm) et UVA2 (320 - 340 nm). Les UVB: ont
une longueur d’onde comprise entre 290 et 320 nm. Le pourcentage d'UVB
augmente de 4% tous les 300 mètres d'altitude. L'épuisement de la couche
d'ozone pourrait permettre la pénétration d'une quantité plus importante de
rayons UVB. Pour plus de détails sur la couche d’ozone consultez :
http://www.epa.gov/docs/ozone/index.html Les UVC: ont une longueur d’onde inférieure à 290 nm et sont stoppés normalement par la couche d'ozone. Ce sont des rayons erythématogènes et peu utilisés en dermatologie. Leur propriété bactéricide est parfois utilisée pour traiter des ulcères cutanés1 . Les
ultraviolets et les rayons visibles occupent la portion centrale du spectre
électromagnétique. Le tableau 1 illustre le spectre électromagnétique au
complet.
Le
rayonnement solaire se compose à 50% d’infrarouge à 40% de lumière visible
et à 10% d’U.V. Dépendant de la latitude, l'altitude, la saison, l'heure, la
nébulosité, la réflexion, la diffusion et la teneur en ozone, ces
proportions peuvent varier (voir tableau 2).
L’intensité
du rayonnement nécessaire pour produirre un érythème avec les UVA est de 500
à 1000 fois plus élevé qu ’avec les UVB. Le soleil émet 100 fois plus de
rayons UVA que de rayons UVB à la surface de la terre. Les longueurs
d'onde les plus courtes sont les plus actives, donc celles dont il faudra se
protéger plus activement.
La réflexion
au niveau du sol est de 85% pour la neige, 17% pour le sable, 5% pour l'eau
et 3% pour l'herbe.
Les UVC sont
bloqués par la couche cornée. Les UVB atteignent à peine l’épiderme tandis
que les UVA atteignent facilement le derme. Définitions utilisées en photothérapie.Sources de radiations
non-ionisantes: sont
utilisées en photomédecine pour émettre une radiation électromagnétique
généralement située entre 200 et 4000 nm. Rayonnement ou Énergie de
radiation (Radiant Energy): est la quantité de radiation électromagnétique exprimée en Joules
(J). 1J=1000mJ
Puissance (Radiant Power):
est le taux de radiation émise par seconde exprimée en watts (W) W = J/sec.
Éclairement énergétique ou
fluence (Irradiance):
est l'intensité par cm2 et est exprimée en W/cm2. En
photothérapie l'intensité est mesurée par un radiomètre et la lecture est
faite en W/cm2 ou mW/ cm2. À noter que cette lecture sera
influencée par la distance qui sépare l'appareil de la source de radiation. Dans un
ciel clair, l’éclairement énergétique des UVB, de source solaire, équivaut à
0,2 mw/cm² et pour les UVA : 3 à 7 mw/cm². Ces valeurs sont
sujets à la variation tel que mentionné plus haut.
Dose d'exposition: est la quantité de rayonnement reçue par la peau par cm2
(éclairement énergétique) par le temps d'exposition. Pour l'UVB thérapie
ceci s'exprime en mJ/ cm2 pour la PUVA en J/ cm2 Dose (mJ/ cm2)
= éclairement énergétique (mW/ cm2) x temps d'irradiation
(secondes) x 0,06 Dosimétrie:
est la mesure de l'énergie de radiation par cm2 de surface
corporelle.
Radiomètre ou Photomètre:
appareil mesurant l'énergie de radiation par cm2 de surface
corporelle/seconde. À noter que cette lecture sera influencée par la
distance qui sépare l'appareil
de la source de radiation.
Dose
Érythémateuse Minimale (DEM) "Minimal
Erythematous Dose (MED)" C’est la plus
faible dose d’UVB qui cause un
érythème perceptible ayant 4 bordures distinctes 18 à 24 heures après
l’exposition. Dose
Phototoxique Minimale (DPM) "Minimal Phototoxic Dose (MPD)" C'est le
minimum d'érythème perceptible qui apparaît en dedans de 72 heures chez une
personne ayant ingéré du 8-MOP (0,4mg/kg), une à deux heures avant de
s’exposer à des doses croissantes de rayons UVA.
L’évaluation préphotothérapeutique (UVB et PUVA):Avant même de recommander un patient en photothérapie aux rayons UVA ou UVB, on évalue la maladie et le patient, puis on discute d’un plan thérapeutique approprié pour chaque patient. Tous les renseignements nécessaires sont fournis au patient, verbalement et par écrit. L’évaluation de la maladie:Si cela
s’avère nécessaire, le diagnostic est confirmé par une biopsie.
Vérifier si la gravité de la maladie justifie
la photothérapie.
Le patient reçoit-il des médicaments
photosensiblisants ou du Méthotrexate?
Sa qualité de vie est-elle vraiment perturbée?
Y a-t-il des antécédents de lupus? de
radiothérapie? des lésions néoplasiques ou prénéoplasiques? Est-il porteur
de naevi atypique (dysplasique)? Il est
primordial de discuter les effets secondaires à court et à long terme
surtout s’il s’agit d’enfants atteints de psoriasis généralisé.
L’évaluation du patient:Avant de
prescrire la photothérapie, le médecin doit se poser plusieurs questions. En
effet, la PUVAthérapie s’adresse surtout à des personnes motivées et
capables d’observer dles recommandations telles que la protection oculaire, la prise de la médication à l’heure
indiquée, et ainsi de suite. Est-ce que le patient est motivé et fiable?
Pourra-t-il suivre les recommandations concernant la protection de la peau
et des yeux? Est-il capable de
se tenir debout dans la cabine? Est-il capable de se déplacer? Demeure-t-il
bien loin du centre de photothérapie? A-t-il
le temps de suivre son traitement? Quelle est la fréquence de
traitements à lui recommander?
L’examen ophtalmologique doit être effectué de routine avant de commencer la PUVAthérapie, puis de façon annuelle. Les anticorps antinucléaires (ANA) et les enzymes hépatiques oivent être vérifiés.
Déterminer le
plan thérapeutique optimal pour chaque patient. Pour traiter le psoriasis,
qu’il s’agisse de PUVA ou d’UVB, il faut déterminer si les rétinoïdes
systémiques devront être administrés de 10 à 14 jours avant le début de la
photothérapie). D’autres traitements en association doivent aussi être
considérés : émollients, goudron, corticostéroïdes topiques, anthraline,
dovonex, tazorac etc.. Il est primordial de discuter avec le patient des effets secondaires à court et à long terme, surtout s’il s’agit d’un enfant atteint de psoriasis généralisé. La sécurité en photohérapieLa sécurité
et le confort du patient:
Le personnel
infirmier qui programme le traitement doit rester à proximité du patient.
Une minuterie additionnelle serait aussi souhaitable.
Les lampes
doivent être couvertes par une gaine en plastique pour prévenir les blessures en cas de chute dans la
cabine de radiation.
Il est
souhaitable d’offrir aux patients de recevoir les traitements tôt le matin
ou tard le soir pour ne pas interrompre leur horaire de travail.
La protection
des yeux ainsi que des organes génitaux mâles doit être soulignée.
La
sécurité de la cabine de photothérapie.
Un bouton
d’arrêt de l’appareil doit être accessible lors du traitement, pour que le
patient puisse s’en servir en cas d’urgence. Les portes doivent s’ouvrir
facilement. Le plancher doit toujours être sec afin d’éviter les chutes en
glissant. Un système de ventilation et de refroidissement est nécessaire,
surtout lorsque l’espace est restreint.
Aspects médico-légaux:Tous les
patients sont susceptibles de subir des brûlures à la suite d’une
photothérapie. Si le traitement est reçu dans une institution, le médecin
ainsi que l’infirmière ou le
technicien sont responsables. Des cours de formation sont offerts par la
« National Psoriasis Foundation » ou la « Dermatology nurse association »
des Etats-Unis. Il est important de suivre les lignes directrices de l’AAD
(Guidelines of Care for Phototherapy and Photochemotherapy J AM ACAD
DERMATOL 1994;31:643-8). Le fait
d’avoir un équipement sécuritaire, un personnel bien formé, un
photothérapiste expérimenté et un patient fiable constitue un atout pour la
réussite du traitement.
LA PHOTOTHÉRAPIE AUX UVBLes
principales indications et contre-indications de photothérapie aux UVB sont
présentées aux tableaux 3 et 4. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Incréements |
Vitiligo + DEM 140 |
DEM 260 |
DEM 380 |
DEM 500 |
||||||||
|
UVB en |
estiamtion |
Temps réel en sec |
UVB en |
estiamtion |
Temps réel en sec |
UVB en |
estiamtion |
Temps réel en sec |
UVB en (J/cm2 ) |
estiamtion |
Temps réel en sec |
|
|
2 |
0.070 |
|
|
0.130 |
|
|
0.190 |
|
|
0.250 |
|
|
|
2 |
0.077 |
|
|
0.143 |
|
|
0.209 |
|
|
0.275 |
|
|
|
3 |
0.085 |
|
|
0.157 |
|
|
0.230 |
|
|
0.303 |
|
|
|
4 |
0.093 |
|
|
0.173 |
|
|
0.253 |
|
|
0.333 |
|
|
|
5 |
0.102 |
|
|
0.190 |
|
|
0.278 |
|
|
0.366 |
|
|
|
6 |
0.113 |
|
|
0.209 |
|
|
0.306 |
|
|
0.403 |
|
|
|
7 |
0.124 |
|
|
0.230 |
|
|
0.337 |
|
|
0.443 |
|
|
|
8 |
0.136 |
|
|
0.253 |
|
|
0.370 |
|
|
0.487 |
|
|
|
9 |
0.150 |
|
|
0.279 |
|
|
0.407 |
|
|
0.536 |
|
|
|
10 |
0.165 |
|
|
0.307 |
|
|
0.448 |
|
|
0.589 |
|
|
|
11 |
0.182 |
|
|
0.337 |
|
|
0.493 |
|
|
0.648 |
|
|
|
12 |
0.200 |
|
|
0.371 |
|
|
0.542 |
|
|
0.713 |
|
|
|
13 |
0.220 |
|
|
0.408 |
|
|
0.596 |
|
|
0.785 |
|
|
|
14 |
0.242 |
|
|
0.449 |
|
|
0.656 |
|
|
0.863 |
|
|
|
15 |
0.266 |
|
|
0.494 |
|
|
0.722 |
|
|
0.949 |
|
|
|
16 |
0.292 |
|
|
0.543 |
|
|
0.794 |
|
|
1.044 |
|
|
|
17 |
0.322 |
|
|
0.597 |
|
|
0.873 |
|
|
1.149 |
|
|
|
18 |
0.354 |
|
|
0.657 |
|
|
0.960 |
|
|
1.264 |
|
|
|
19 |
0.389 |
|
|
0.723 |
|
|
1.056 |
|
|
1.390 |
|
|
|
20 |
0.428 |
|
|
0.795 |
|
|
1.162 |
|
|
1.529 |
|
|
|
21 |
0.471 |
|
|
0.875 |
|
|
1.278 |
|
|
1.682 |
|
|
|
22 |
0.518 |
|
|
0.962 |
|
|
1.406 |
|
|
1.850 |
|
|
|
23 |
0.570 |
|
|
1.058 |
|
|
1.547 |
|
|
2.035 |
|
|
|
24 |
0.627 |
|
|
1.164 |
|
|
1.701 |
|
|
2.239 |
|
|
|
25 |
0.689 |
|
|
1.280 |
|
|
1.871 |
|
|
2.462 |
|
|
|
26 |
0.758 |
|
|
1.409 |
|
|
2.059 |
|
|
2.709 |
|
|
|
27 |
0.834 |
|
|
1.549 |
|
|
2.264 |
|
|
2.980 |
|
|
La classification de la peau
en différents phototypes, bien qu’elle nous donne une idée approximative du
dosage initial à administrer en l’absence de phototests cutanés, n’est pas
sans poser de probème. En effet, on peut facilement rencontrer un phototype
de peau I dont la DEM atteint 150 mJ lors des phototests, et un phototype de
peau IV où la DEM ne dépasse pas 120 mJ (tableau 8). Des études ont confirmé
que les tendances à brûler ou à bronzer rapportées par les patients ne
constituent pas un moyen fiable de déterminer la sensibilité de la peau aux
rayons ultraviolets2.
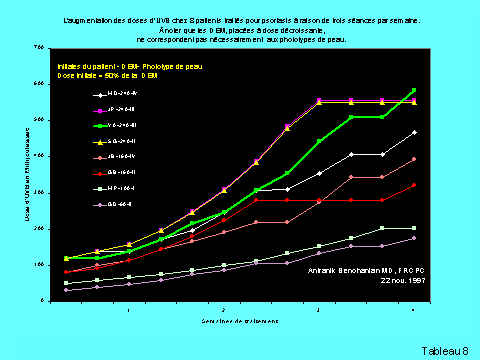
Pour savoir
comment administrer la dose initiale des rayons UVB en mJ/cm2,
ainsi que les incréments par la suite, une fois que les phototests aux UVB
sont effectués, voir le tableau 9.
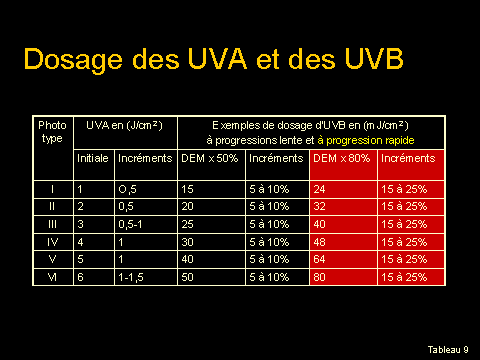
Exemple: Dans une cabine d’exposition (Ultralite) UVA/UVB munie de 8 lampes UVB à large spectre, la dose d’exposition de 1mJ/cm2 correspond à environ 1 seconde. S’il y a 16 lampes, la dose correspondante en seconde sera d’une demi-seconde.
La DEM se
détermine en irradiant différentes doses d’UVB sur 8 petites fenêtres
carrées de 2cm sur 2cm sur le dos du patient. Il est à
noter que cette dose dépend de différents facteurs tels que la source
d’irradiation, le phototype de peau, la distance de la source ainsi que le
temps d’exposition.
Pour les
patients appartenant aux phototypes de peau I à II, on estime que la dose
DEM varie entre 20 et 60 mJ/cm2 (ce qui équivaut à 12 à 25
minutes de soleil en juillet, au Nord Est des EU) et pour le phototype de
peau III on estime que la DEM varie entre 20 et 120 mJ/cm2.
Le dosage des rayons UVB en cours de traitement
Il existe
deux modes d’administration de la photothérapie (voir le tableau 9).
La
progression à dose élevée
est idéal pour traiter les personnes souffrant de psoriasis en plaques
minces, les enfants et les femmes enceintes. Dans 70% des cas, on obtient un
blanchiment en 30 traitements ou moins. Les UVB sont donnés administrés à
raison de 4 à 5 fois par semaine.
Le traitement initial équivaut à 80% de la DEM. Les augmentations sont de l’ordre de 15 à 20% pour les 20 premiers traitements. Par la suite, les doses sont maintenues ou légèrement augmentées. Lorsque les lésions blanchissent, on envisage un traitement d’entretien.
Le
progression à basse dose:
si le psoriasis est inflammatoire ou si le patient appartient à un phototype
de peau I ou II, on commence le traitement avec une première dose à 50% de
la DEM. Les augmentations se font moins rapidement, c’est à dire de 5 à 10%
après chaque traitement.
Avant d’administrer des traitements d’entretien, on doit discuter de cette option avec le patient et prendre la décision après avoir évalué sa qualité de vie.
Les
traitements d’entretien d’après Stern, s’effectuent à un rythme de deux par
semaine pour 4 à 8 semaines,
puis à une fréquence d’une fois par semaine pour 8 semaines.
Sources de radiation UVB:
Les lampes
conventionnelles (FST72T12/UV-B/HO
BBUV-B) utilisées dans la plupart des cabines d'UVB en Amérique du Nord
émettent des rayons UVB dont la distribution spectrale s'étale de 290 à 320nm (BB-UVB, Broad Band UVB)
Les lampes
standards (Phillips TL12®)
utilisées en Europe, ont un spectre s'étalant de 260 à 380nm.
Les études
ont démontré que les UVB mesurant entre 305 et 315 nm étaient efficaces pour
contrôler le psoriasis,
contrairement aux UVB <300 nm qui, tout en causant de l’érythème, n’avaient
aucun effet sur le psoriasis.
En 1976, le suédois Torkil Fischer a décrit pour
que la bande 313 nm (UVB à spectre étroit) permettait d'obtenir un
blanchiment du psoriasis avec un risque nettement diminué d'érythème
phototoxique3.
En 1980, Parrish et Jaenicke
sont parvenus aux mêmes résultats4.
La photothérapie UVB à spectre étroit utilise une nouvelle
lampe Philips TL-01/100 W NBUV-B®
centré sur 311 nm5,6.
D’autres
études 7,8,9,
ont confirmé, hors de tout doute, l'efficacité
des UVB à spectre étroit pour enrayer le psoriasis.
Coven et ses collègues10
ont pu blanchir le psoriasis chez les phototypes de peau V et VI
qui résistaient à la photothérapie UVB conventionnelle.
Les UVB à
spectre étroit sont disponibles aux E.U. depuis 1996. Au Québec, au moment
de cette publication, il existe peu de centres munis de TL01.
Les lampes
TL01 sont maintenant disponible en Amérique du Nord) par Daavlin et
Ultralite au prix de US$135.00 la lampe.
La photothérapie aux UVB à
spectre étroit est vouée à un avenir prometteur du fait qu'elle ne présente
pas les contre-indications de la puvathérapie, comme la grossesse, ni ses
inconvénients, comme le port de lunettes et l'intolérance digestive aux
psoralènes. On pense que le risque carcinogène est probablement moindre que
celui des UVB conventionnels par ce que cette lampe n'émet pas de d'UVB
courts inférieurs à 300nm11. Toutefois, le risque carcinogène
n’est pas exclu pour le moment.11
Stern12
est d’avis
que même si l'efficacité de la TL01 se révèle identique ou supérieure à
celle obtenue par la Puvathérapie, il reste à voir s'il s'agit là d'une
vraie percée dans le traitement du psoriasis ou d'un modeste pas vers cet
objectif. Avant de mettre la PUVA à l'écart, il faudrait s'assurer que non
seulement la TL01 est aussi efficace que la PUVA, mais qu'elle offre aussi
une rémission d'une durée égale à celle de la PUVA.
Du point de vue technique,
il faut reconnaître que l'administration des UVB à 313nm exige beaucoup plus
de délicatesse et d’habileté que celle des UVB conventionnels ou la PUVA.
Les incréments10
de dosage de
ces nouvelles lampes sont inférieurs à ceux des UVB à large spectre.
L’incidence d'érythème inexpliqué et imprévu est plus fréquente.
Cela dit, l’efficacité des
UVB à 313nm est supérieure à celle des UVB conventionnels. Toutefois, dans
l’une des études récentes, on rapporte que le taux de récidives à la suite
d’une monothérapie à spectre étroit a été comparable à celui de la
combinaison étretinate-PUVA (rePUVA)13
Contrairement
à la PUVA, pour laquelle les risques d'effets secondaires à long terme sont
bien documentés, il n'existe pas, à ce jour, d'études comparatives évaluant
les risques à long terme des UVB, qu’ils aient un spectre large ou étroit.
Les études chez les animaux ne
sont pas plus concluantes 14,15
Strern fait preuve d’un optimisme prudent à propos de la photothérapie au TL01, en indiquant qu’indépendamment du spectre utilisé, pour un nombre égal de traitements, les UVB causeraient moins de dommage que les UVA 16,17
Le recueil de données du patient
La date, la
dose de rayons, l’heure du traitement administré, les régions cachées, la
dose cumulative totale en date du traitement doivent tous figurer sur des
colonnes différentes.
Le dossier
doit contenir les effets secondaires : érythème, prurit, etc.. que le
patient a déjà expérimenté. Une autre feuille séparée doit mentionner,
lorsque cela s’applique, les antécédents de cancers cutanés et de naevus
atypiques. Le patient est invité à faire un autoexamen périodique, dans le
but de découvrir des lésions suspectes.
Traitements associés aux UVB:
Dans le passé, les rayons
UVB étaient surtout utilisés en combinaison avec du goudron (Goekerman), de
l’anthraline (Ingram) et des crèmes ou des onguents à base de
corticostéroïdes. De nos jours, ces produits sont de moins en moins utilisés
cédant ainsi leur place à certains dérivés vitaminiques: le calcipotriol, un
dérivé de la vitamine D (Dovonex). L’ajout de
calcipotriol réduit jusqu’à 30 à 40% le nombre de traitements requis pour
blanchir le psoriasis 18,19
Il en est de
même pour le tazarotene (Tazorac), un dérivé de la vitamine A.
(1) UVB thérapie en association avec du goudron:
William H.
Goeckerman 1925 a mis sur pied
son fameux Régime Goeckerman, qui comprend les étapes suivantes:
1.
Une application de goudron de houille en
milieu hospitalier à raison de trois fois par jour.
2.
Un bain à l'huile pour éliminer l'excès de
goudron.
3.
Une exposition aux rayons UVB après le bain.
4.
Un traitement quotidien pour une période de 3
à 4 semaines jusqu'au blanchiment du psoriasis.
Les médecins
qui ont utilisé la méthode Goeckerman pour traiter le psoriasis considèrent
que ce mode de traitement est un mode efficace et relativement sécuritaire.
De plus, cette méthode offre une longue période de rémission.
Les
complications de l'association goudron-UVB semblent être mineures: érythème,
prurit et sécheresse. Ces problèmes peuvent être contrôlés par des
émollients, comme la vaseline
et l'ajustement des doses subséquentes de rayons.
(2) UVB thérapie en association avec de l'anthraline:
La Technique d'Ingram
consiste en une application quotidienne d'anthraline, suivie
d'un bain à l'huile de goudron, puis d’une exposition aux rayons UVB.
De 3 à 5 séances par semaine sont
requises pour le blanchiment du psoriasis. L'anthraline peut être appliqué
en faible concentration (de 0.1% à 0.4%) et gardé durant toute la nuit sous
de vieux pyjamas [ l'anthraline peut tacher la peau et les vêtements ]. Il
peut aussi être appliqué en plus forte concentration (de 1% à 4%), gardé
entre 20 et 30 minutes et lavé
par la suite. Il semblerait que de nouvelles préparations tel que Micanol
(1% d'anthraline) soient plus commode à appliquer que les préparations
actuellement sur le marché.
L’UVB photothérapie en doses subérythémateuses vs des doses érythémateuses dans le blanchiment du psoriasis.
On a constaté que des doses subérythémateuses d’UVB, que se soit à spectre large ou étroit, pouvaient blanchir le psoriasis sans passer par l’érythème 20,21,22 .. On est même parvenu a éliminer les lésions de psoriasis chez des personnes appartenant a des types de peau I et II. Cette méthode s'avère utile surtout chez les enfants et les femmes enceintes. Même la puvathérapie en doses subérythémateuses a été rapportée comme étant efficace.
Dans les cas
de dermite atopique, l’association UVA & UVB est efficace. La photothérapie
à domicile est un sujet fortement controversé.
Les effets secondaires spécifiques aux UVB
Les rayons UVB sont les
rayons responsables des coups de soleil et des brûlures à court terme, et du
photovieillissement de la peau à long terme. La peau développe
progressivement des ridules, puis de rides profondes. Elle devient lâche,
tannée. Par endroit on voit tantôt de fines télangiectasies, tantôt des
lentigos et des kératoses solaires23.
En plus des
kératoses solaires, on peut retrouver des cancers de peau: épithélioma
basocellulaire, épithélioma spinocellulaire et cataractes.
Face aux rayons ultraviolets
de type B, la peau se défend de deux façons: par l'épaississement de la
couche cornée et par la formation d'un filtre de mélanine dans les cellules
épidermiques24,24.
Pour prévenir
les cancers de peau à long terme, on évite de traiter aux rayons UVB les
patients qui ont:
1]
déjà souffert d'un cancer de peau.
2]
fait usage d'arsenic.
3]
fait usage d'immunosuppresseurs.
4]
déjà subi de la radiothérapie.
LA PUVATHÉRAPIE
L’historique
Consommer des
extraits de plantes contenant des psoralènes puis s’exposer au soleil est
une technique pour traiter le vitiligo qui existe depuis des millénaires. La
PUVAthérapie (L'acronyme PUVA dérive de
Psoralène et de
UVA (rayons ultraviolets de type
A) a été administrée pour la première fois au XIIIe siècle par
les Égyptiens, qui ont utilisé un extrait de plante poussant dans le delta
du Nil. Cette plante était l’Ammi majus Linnaeus. Le produit était
pris per os sous forme de poudre. On en prenit de 4 à 12 g par jour
pour 15 jours et durant cette période, les régions affectées étaient
exposées au soleil. Cette forme de thérapie a été utilisée jusqu’au milieu
du XXe siècle.
Fahmy et Abu-Shady ont été
les premiers à extraire les composés cristallins de la plante Ammi majus
Linnaeus et les ont baptisés « ammoïdin »
.
Les trois ingrédients actifs de l’ammoïdin sont le 8-methoxypsoralène
(8-MOP), le 5-methoxypsoralène (5-MOP), et le 8-isoamyleneoxypsoralène; tous
des dérivés de la coumarine.
En 1947, en Égypte, Fahmy et El Mofty ont utilisé pour la première fois les psoralènes purifiées pour traiter le vitiligo28. Jusqu’en 1967, le soleil était la principale source d’irradiation utilisée pour repigmenter la peau, en association avec des psoralènes administrés par voie topique ou systémique. On s’est aussi servi de la lampe fluorescente (black light). Par la suite, les cabines de photothérapie munies de lampes UVA à haut débit ont été inventées.
Dans les années 1950, Pathak,
Fitzpatrick et Musajo ont démontré que les psoralènes sont activés par les
rayons UVA et qu’ils inhibent la réplication cellulaire en se liant à l’ADN
29,30 . En 1972, Mortazani a
démontré que l’application locale de psoralènes sur la peau, suivie d’une
exposition aux rayons UVA de faible intensité, blanchissait le psoriasis
31
En 1974, Parrish et ses
collèges ont démontré que la prise de psoralènes per os suivie d’une
exposition aux UVA de forte intensité faisait blanchir le psoriasis
Ce nouveau concept a été appelé « photochimiothérapie » afin
de souligner à la fois l’importance du médicament photosensibilisant et
celle des rayons UVA dans l’inhibition de la prolifération épidermique32.
La
photochimiothérapie aux psoralènes consiste à administrer un médicament à
base de psoralènes, puis de faire suivre par une exposition UVA une à deux
heures plus tard.
En 1975, la
première séance de PUVA a été administré dans la province de Québec à
l’Hôpital Saint-Luc (aujourd’hui affilié au Centre Hospitalier de
l’Université de Montréal), dans une
cabine munies de lampes UVA, placées en position verticale sur les
quatre murs de la cabine.
La pharmacologie des psoralènes:
Les
psoralènes appartiennent à la famille des furocoumarines. Ces dernières sont
présentes dans plusieurs fruits et plantes (exemples : lime, citron, céleri,
betterave, panais et persil).
Il existe
trois types de psoralènes :
Le
8-méthoxypsoralène (8-MOP), sous forme de cristaux (Oxsoralen) ou de liquide
(Oxsoralen-Ultra ou Ultramop)
Le
Trisoralène
Le
5-méthoxypsoralène (5-MOP), qui est surtout employé en Europe.
Le 8-MOP est
le psoralène le plus utilisé pour administrer la PUVA. Ce produit est
absorbé et diffusé dans tous les tissus. La photosensibilisation survient de
une à trois heures après
l’ingestion. Le patient prend son médicament de une à deux heures avant
l’horaire de son exposition aux UVA. Le 8-MOP est métabolisé par le foie et
excrété dans les urines après un délai de 12 à 24 heures. C’est pour cette
raison que le patient doit continuer de protéger sa peau et ses yeux pendant
les 24 heures qui suivent
l’absorption de ce médicament. Le dosage du 8-MOP sous forme de cristaux et
liquide est indiqué au tableau 10.
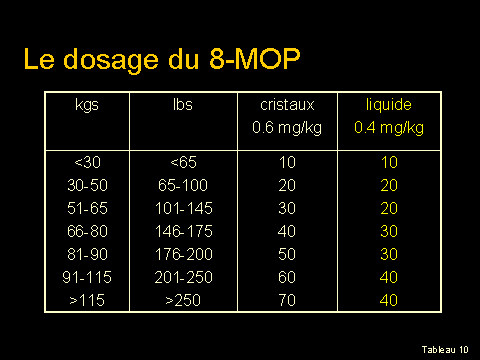
On sait qu’il
existe une corrélation entre le degré de photosensibilité et le type de
repas pris avec le médicament. La concentration sanguine du 8-MOP est élevée
lorsque le médicament est pris l’estomac vide, basse lorsqu’il est pris avec
un repas gras et moyen lorsqu’il est ingéré avec un repas faible en gras.
L’absorption
du médicament varie d’un patient à l’autre, et aussi chez un même patient.
Pour minimiser ces variations, le repas pris avant le traitement doit être
d’une même qualité.
La photochimie des psoralènes:
Le mécanisme d’action exact
des psoralènes, n’est pas clairement établi. Il est situé au niveau du noyau
(ADN), des membranes des cellules épidermiques, dermiques, endothéliales
ainsi qu’au niveau de certains constituants cytoplasmiques (enzymes, ARN,
lysosomes). Deux types de réactions photochimiques, indépendantes l’une de
l’autre ont été identifiées33
La réaction de type I
induit
l’inhibition de l’ADN par la formation de photoadditions monofonctionnelles
et bifonctionnelles. Elle est indépendante de la présence d’oxygène.
La réaction de type II
Le psoralène
photoactivé par son interaction avec l’oxygène provoque la formation
d’oxygène singulet et de radicaux libres très agressifs causant de
l’érythème, de l’oedème et un dommage à la membrane cellulaire.
L’efficacité des psoralènes.
Il existe un grand nombre de
travaux de recherche -- provenant d’Europe et plus particulièrement du
Royaume-Uni -- comparant
l’effet du 8-MOP et du 5-MOP. La conclusion qu’on peut en tirer est que le
5-MOP pris à une dose de 1.2 mg/kg est aussi efficace que le 8-MOP, mais il
présente moins d’effets secondaires (nausées, étourdissement et prurit)34
L’évaluation pre-PUVAthérapie
Avant de
recommander une PUVA thérapie, l’on doit s’assurer que la maladie dont
souffre le patient répond à ce genre de traitement et que le patient peut
s’y soumettre. De plus, on devrait administrer la PUVAthérapie loesque les
modes de traitement conventionnels ont échoué (calcipotriol, tazarotène,
corticostéroïdes topiques, goudron, anthraline, rayons UVB, etc)..
Ce traitement
s’adresse surtout à des personnes motivées et capables d’observer les
recommandations telles que la protection oculaire, la prise des médicaments
à l’heure indiquée, et ainsi de suite.
Les indications de la PUVAtherapie
Les
principales indications de la PUVAthérapie sont présentées aux tableau 11.

Les
indications moins fréquentes sont: l’urticaire pigmentaire, la maladie hôte
contre greffon et le granulome annulaire généralisé. On peut trouver une
longue liste de maladies pouvant être traitées par la PUVAthérapie dans les
livres, mais les plus fréquents sont citées ici.
Dans le cas
particulier du psoriasis, on a recours à la PUVA lorsque:
a) le
psoriasis incapacite considérablement le patient.
b) le
psoriasis couvre plus de 30 %
de la surface totale de la peau.
c) les
plaques de psoriasis sont épaisses (les rayons UVA sont plus pénétrant, donc
plus efficaces).
d) le
psoriasis a atteint les régions palmo-plantaires
e) les
régions unguéales sont atteintes;
f) le
psoriasis est inflammatoire (érythrodermique)
g) la
photothérapie aux rayons UVB a échoué.
Le vitiligo peut aussi
être traité par la PUVAthérapie. Avant de se rendre compte si le traitement
est efficace, il faut administrer entre 40 et 50 séances d'exposition aux
rayons UVA Il faudrait entre
100 et 300 séances pour en arriver à une pigmentation satisfaisante.
L'assiduité du patient est donc essentielle pour la réussite du traitement.
La fréquence des séances varie de une à trois fois par semaine; il ne faut
toutefois pas dépasser le rythme d'un traitement aux deux jours. Malgré le fait que de 70 à 80% des
patients obtiennent une certaine repigmentation grâce à la PUVAthérapie,
moins de 20 % des patients vont obtenir une repigmentation complète35
. Entre 30 et
40% des patients traités peuvent espérer en arriver à une repigmentation
partielle. Les patients ayant la peau foncée répondent mieux à la
puvathérapie par ce qu’ils tolèrent de plus fortes doses de rayons UVA. Les
enfants répondent mieux au traitement que les adultes. En général, le
vitiligo sur le visage, le tronc et la région proximale des membres répond
bien au traitement à cause de la présence des racines de poils. La région
distale des membres, la région péri-orificielle ainsi que les lésions
occupant des zones de
dermatomes ne répondent presque pas au traitement. Plus les lésions sont
récentes et limitées, plus grandes sont les chances de guérison. En général
le vitiligo est une maladie qui répond très lentement au traitement.
Plusieurs études ont
démontré que l’eczéma atopique répondait bien aux traitements ultraviolets.
Le spectre d’action de l’eczéma semble être à des longueurs d’ondes plus
élevées que celui du psoriasis. L’association des UVB et des UVA (surtout
des UVA1) semble être plus efficace pour traiter cette maladie que les UVB
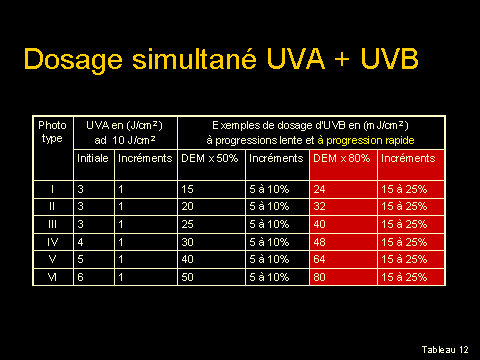
seuls36 (voir tableau
12) La PUVA aussi est efficace. Selon une étude japonaise, l’amélioration de
l’eczéma atopque par les UVB et la PUVA serait due à l’effet aantimicrobien
de ces derniers37.
Les contre-indications absolues
Il ne faut pas administrer la PUVAthérapie systémique à des
patients âgés de 10 ans et moins de même qu’aux femmes enceintes et à celles
qui allaitent. Il
faudrait plutôt considérer les autres options thérapeutiques.
Les patients
ayant des antécédents de naevus dysplasiques et de cancers cutanés de type
mélanome ou non-mélanome doivent être exclus. Il en est de même pour les
patients atteints de lupus érythémateux et de xérodermie pigmentaire.
Les contre-indications relatives
comprennent la cataracte, la prise de médicaments photosensibilisants durant le traitement, l’infection au virus de l’immunodéficience humaine, de même que les antécédents de radiation ionisante, d’ingestion d’arsénic et de photosensibilité.
D’autres
facteurs aussi entrent en ligne de compte, comme l’étendue de la maladie,
les traitements antérieurs subis, la fiabilité du patient quant au
traitement et aux mesures de protection nécessaires à prendre lors de la
puvathérapie.
Détermination de la dose initiale de rayons UVA
Les
phototests recommandés pour déterminer la dose phototoxique minimale (DPM)
doivent être effectués en J/cm2. À l'instar de la photothérapie aux UVB, les
phototests pré-PUVA sont souhaitables, mais ne sont pas indispensables. Ils
contribuent à diminuer le temps du blanchiment du psoriasis tout en nous
facilitant le calcul de la dose initiale optimale.

Le dosage des rayons UVA.
Il existe des tableaux (tableau 13) qui permettent d’obtenir le temps
d’exposition nécessaire pour administrer la dose requise selon l’éclairement
énergétique. Toutes les cabines de photothérapie modernes sont munies d’un
dispositif capable de calculer la durée d’émission requise en minutes, qui
correspond à la dose de rayons UVA (en J/cm2) prescrite.
on peut
calculer le temps d’exposition qui correspond a dose d’UVA de la façon
suivante:
Temps d’exposition (en minutes ) =
Dose d’UVA désirée (J/cm2)
0.06 x
éclairement énergétique (mW/ cm2)
Le temps
d’exposition est calculé à partir d’un détecteur d'intensité de la radiation
(le radiomètre), placé au milieu de la cabine. Sa fonction est de lire
l'intensité de l'émission des rayons en tout temps et d'ajuster la dose
prescrite en conséquence.
L'intensité de l’émission des rayons varie selon:
1- la
température de la lampe (plus la lampe est chaude, plus son intensité est
élevée).
2- l'âge de
la lampe ( plus la lampe est âgée, plus elle perd de son intensité).
3- les
variations du courant électrique.
4- d’autres
facteurs
La dose
initiale en joules correspond au phototype de peau auquel le patient
appartient (tableau 9).
Par exemple,
pour un patient ayant un phototype de peau I, on commence le traitement avec
une dose de 1 J/cm2,
pour un phototype II, avec une dose de 2 J/cm2 etc. Les
augmentations varient entre 0,5 et 1,5 J/cm2, sauf si le patient
a une peau extrêmement sensible, comme dans les cas de vitiligo. Les
augmentations se font alors à un rythme plus lent, c’est à dire de 0,25 J/cm2
à la fois.
En Europe la
DPM est faite de routine et la dose initiale est de 1 DPM. En Angleterre on
prescrit comme traitement initial, 70% de la DPM.
La fréquence
des traitements est de 3 fois par semaine en Amérique du Nord : Lundi,
Mercredi et Vendredi tandis qu’en Europe on donne le Lundi, Mardi, Jeudi,
Vendredi.
La PUVA
topique: une solution topique de 0,01 à 0,1% de 8-MOP est appliquée de 30 à
60 minutes avant l’exposition aux UVA. Ce traitement est utilisé pour des
lésions limitées comme le vitiligo, ou les dermatoses palmo-plantaires.
Malgré son efficacité, ce mode de traitement peut occasionner des brûlures
graves étant donné que la dose thérapeutique et la dose phototoxique sont
très proches (voir tableau 14).

Sources de radiation UVA:
L'exposition aux rayons UVA
se fait dans des cabines munies de lampes permettant de traiter le corps
entier. Il existe aussi des appareils mains-pieds. La source la plus
employée pour émettre des rayons UVA est la lampe UVA à haut débit (high
output UVA). Les lampes sont des tubes à vapeur de mercure à basse pression
F72T12/BL/HO UVA dont la
distribution spectrale s'étale de 320 à 400nm et atteint un sommet à 352 nm.
Ces lampes émettent moins de 3% d’UVB, 20% d’UVA2 (320-340), 65-75% dans la
bande de 320-360nm dont le pic est à 350 nm (Warwik L. Morison). À noter que
la bande 325 nm est plus efficace que la bande 352 par ce que son spectre
d'action se rapproche de celui des psoralènes qui est de 335 nm38,39.
Les résultats
On a trouvé que la bande
340-400 nanomètres (UVA1), à
haute dose, est efficace pour traiter les exacerbations aiguës de la dermite
atopique40,41
et de la
sclérodermie localisée42
. Une
troisième indication pour ce genre de rayons est le traitement de
l’urticaire pigmentaire. La dose donnée est d’environ 130 Joules/cm2
par session à l’aide d’une source de lampe Halogène (Metal Halogen). La
durée du traitement est de 30 à 40 minutes et le coût de l’appareil peut
facilement atteindre les 50 à 80 milles dollars américains.
Une des
études menée par Krutman a conclu qu’on obtenait un meilleur résultat avec
l’association de 8-MOP et les rayons UVB à spectre étroit, qu’avec les
rayons UVB à spectre étroit tous seuls. Lors d’une étude où l’on a employé
la combinaison des rayons UVB à spectre large avec le 8-MOP, on n’est pas
parvenu à obtenir un meilleur résultat. Les lampes UVA qu’on se sert
présentement ont un pic à 350 nm.
En 1981, en
utilisant le protocole américain, 89% des patients ont vu leur psoriasis
blanchir après 25 séances réparties sur douze semaines, en moyenne. La dose
cumulative était de 191 joules pour le phototype de peau I et de 296 pour le
phototype de peau IV.
Lors d’une expérience
européenne effectuée sur 3000 patients, 90% des patients ont obtenu un
blanchiment de leur psoriasis en ayant 4 séances de PUVAthérapie par
semaine. Le nombre de traitement et la dose cumulative (96J/cm2)
étaient inférieurs à ceux du protocole de traitement utilisé aux Etats-Unis43
D’autres formes de PUVAthérapie
Le bain
PUVAthérapie (PUVA Bath). Selon le protocole du
Women’s College Hospital de Toronto, on dilue 10 capsules de 8-MOP liquide
(10mg/capsule) dans un demi-verre d’eau bouillante, que l’on ajoute à 40 L
d’eau tiède dans le bain. Le patient prend son bain dans cette solution (2.5
mg/L) pendant 15 minutes. Après avoir asséchée la peau du patient, on expose
ce dernier aux rayons UVA, en commençant par une intensité de 0,25 J/cm2
et en augmentant de 0,25 J/cm2
par séance. L’exposition aux rayons UVA devrait avoir lieu préférablement
dans les 15 minutes qui suivent le bain. Après 15 minutes, l’efficacité du
8-MOP diminue graduellement pour devenir nulle après 4 heures44,45.
La douche PUVA (Shower PUVA). Le principe est le même que celui du bain PUVA. Un appareil spécialement conçu à cet usage permet au patient d’obtenir la solution de 8-MOP sous forme de douche durant 15 minutes, après quoi ce patient s’expose aux rayons UVA de la même façon.
La PUVAthérapie en
maillot de bain (Bathing suit PUVA). Lorsque l’on
emploie cette technique, on met la peau en contact avec la même solution de
8-MOP que celle utilisée pour le bain PUVA. Une quantité de
0,8 mL de 8-MOP (à une concentration de 1%) est ajoutée à 2 L d’eau afin
d’obtenir une concentration de 3,75 mg/L. Le maillot de bain est trempé dans
cette solution pendant 5 minutes et, après avoir essoré l’excès d’eau, le
patient le porte avec un imperméable pendant 15 minutes. Immédiatement après
avoir enlevé l’imperméable, le patient reçoit une dose initiale de rayons
UVA de 4 J/cm2. Les augmentations subséquentes seront de l’ordre
de 0,5 J/cm2 chaque 2 jours46
La
PUVAthérapie locale (Topical PUVA).
Ce traitement
est utilisé pour des lésions limitées comme le vitiligo ou les dermatoses
palmoplantaires. Malgré son efficacité, ce mode de traitement peut causer
des brûlures graves étant donné que la dose thérapeutique
et la dose phototoxique sont très rapprochées.
Lorsque l’on
utilise cette technique, on prépare une concentration de 0,01 à 0,1% de
méthoxalen dans une base de petrolatum (certains préfèrent le Cetaphil). On
recommande au patient d’appliquer cette préparation sur les régions
affectées 20 minutes avant son exposition aux rayons ultraviolets. Il est
préférable que cette application se fasse sur place. La dose initiale de
rayons UVA est de 0,25 J/cm2 et les incréments, de 0,25 J/cm2
par séance. Il est fortement conseillé de faire un test sur une petite
région d’environ 1 cm afin d’évaluer la tolérance du patient à ce traitement
et de prévenir les brûlures sur une plus grande surface dans le cas où le
patient réagirait mal. Si une brûlure se manifeste, la concentration du
méthoxalen est diminuée à 0,01%. Une exposition aux rayons UVA à la suite de
l'application d'onguent peut entraîner occasionnellement de l’érythème, une
sensation de brûlure et des brûlures de deuxième degré. Une
hyperpigmentation péri-lésionnelle peut survenir avec cette forme de
thérapie.
Les traitements associés à la PUVAthérapie
Les
traitements associés à la PUVAthérapie ont pour but de minimiser la dose
cumulative d’exposition aux rayons UVA, et de diminuer la toxicité des
autres modes de , afin d’offrir un traitement plus efficace au patient. Les
traitements associés peuvent être des agents systémiques ou topiques, ainsi
que des rayons UVB. Les agents kératolytiques ont pour but de diminuer
l’épaisseur des plaques de psoriasis.
Le calcipotriol, les rétinoïdes – y compris la nouvelle forme de rétinoïdes -- les corticostéroïdes topiques, l’anthraline, le tazarotene, le méthotrexate et les rayons UVB peuvent tous être utilisés en association avec la PUVA.
D’autres
agents tels que la cyclosporine, la plasmaphérèse, l’interféron alpha et
l’hydroxyurée ont été associés à la PUVAthérapie.
Le
calcipotriol. La plus
ancienne étude en ce qui a trait à l’association Calcipotriene et PUVA
remonte à 199447.
La calcipotriene est aussi
connue sous le nom de calcipotriol en Europe. Dans cette étude on a noté que
64% des patients traités avec du calcipotriol ont obtenu un blanchiment de
leur psoriasis plus rapidement, et cela a nécessité 26,5% moins de rayons
UVA. Chez 18% des autres patients, le côté traité avec le calcipotriol n’a
pas blanchi, mais a mieux répondu au traitement. Enfin, le calcipotriol et
le placebo ont donné le même résultats chez les autres patients (soit 18%).
Il est important de noter qu’une épaisse couche de calcipotriol pourrait
bloquer les rayons UVA. La concentration de calcipotriol a diminué de 28%
après exposition aux UVA, en présence de psoralènes.
L’étude la plus récente
décrivant l’augmentation de la performance des rayons UVB et de la PUVA par
le calcipotriol est celui de Koo48.
Les
rétinoïdes.
La PUVAthérapie peut aussi être utilisée avec des agents systémiques, les
plus populaires étant les rétinoides.
Ainsi, La
re-PUVA consiste à administrer des rétinoïdes, comme l’acitrétine ou de
l’isotretinoïne, avec la PUVA. Le rétinoïde le plus efficace était
l’étretinate, mais celui-ci a cessé d’être produit, et il a été remplacé par
l’acitrétine. La rePUVA réduit de 30% la dose d’UVA requise pour blanchir le
psoriasis.
La dose
recommandée d’acitrétine est de 0,75 à 1mg/kg/jour. Après 10 à 14 jours, on
commence la PUVA. Lorsque le
psoriasis blanchit, l’on cesse d’administrer les rétinoïdes et l’on diminue
graduellement la fréquence des séances de PUVA.
Il est préférable d’utiliser
l’association isotrétinoïne et chez la femme susceptible d’être enceinte,
même si cette association pourrait être moins efficace que l’acitrétine, par
ce que la tératogenèse de l’isotrétinoïne est de plus courte durée.49
Les rétinoides peuvent aussi
être utilisés avec la PUVA topique, comme dans le cas des dermatoses
palmo-plantaires50.
Le
méthotrexate. L’association
PUVA et méthotrexate peut comporter des risques. Le méthotrexate peut
augmenter la photosensibilité et favoriser l’apparition de néoplasmes, ce
qui augmente le risque de cancer lié à la PUVA16
.. On a aussi
rapporté un cas où la PUVA, administrée à un patient prenant du
Méthotrexate, a entraîné une insuffisance hépatique.
La
cyclosporine. L’association
PUVA et cyclosporine pour traiter le psoriasis a été étudiée en 1990 par
Petzelbauer51
.
L’association étrétinate et PUVA a donné des résultats supérieurs à ceux de
l’association cyclosporine et PUVA. Cette dernière association est donc
réservée à ceux qui ne tolèrent pas les rétinoïdes.
En 1992, Gardeazabal52
a utilisé la
PUVA et la cyclosporine pour traiter un homme âgé de 53 ans souffrant de
dermite chronique actinique. Il a obtenu une certaine amélioration.
La plasmaphérèse. La PUVA a aussi été utilisée en association avec la plasmaphérèse pour contrôler l’urticaire solaire.
Interferon alpha. Cette combinaison a été utilisé pour traiter des cas de lymphomes cutanés à cellules T. La première étude remonte à 1990; Kuzel et ses collègues53 ont traité une série de patients atteints de lymphomes cutanés à cellules T à différents stades, et ont constaté une régression complète chez 80% d’entre eux, et une bonne réponse chez 93% des patients. Cette combinaison est surtout employée pour traiter les lymphomes cutanés à cellules T au cours du stade prétumoral.
Les précautions à prendre lors de la puvathérapie
D’abord l’on doit s'abstenir
d’aborber des agents photosensibilisants, qu’il s’agisse de médicaments,
d’aliments ou d’autres substances. Ensuite, on doit se protéger les yeux
avec des lunettes enveloppantes ou de verres de contact anti-UV. Enfin, on
doit se protéger la peau.
Les agents photosensibilisants.
Les
médicaments. Dans un document intitulé Agents photosensibilisants (juillet
1994) et préparé par Mme Suzanne Goyette, pharmacienne, et le Dr Nathalie
Provost, l’on peut trouver une liste exhaustive de médicaments
potentiellement photosensibilisants. Le CD-ROM DermInfoNet de l’AAD mise à
jour annuellement est aussi une bonne source de référence.
Exemples d’aliments photosensibilisants
Les limes, figues, persil, panais, moutarde, carottes et céleri sont photosensibilisants.
Exemples de médicaments photosensibilisants
Antidépresseurs (Elavil, Tofranil), les antihistaminiques (Periactin,
Benadryl),
Antimicrobiens (Tetracyclines, Bactrim, Septra), les neuroleptiques
(Largactil, Moditen, Mellaril),
Diurétiques
(Lasix, Hydrodiuril)
Hypoglycémiants (Diabinese, Mobenol)
Anti-inflammatoires (Naprosyn,
Feldene, Clinoril) et d'autres médicaments (Capoten, Tegretol, sulfate de
Quinidine).
La protection oculaire
Dans la cabine de puvathérapie
Le patient doit se protéger
les yeux avec des lunettes de type coque "goggles" sauf dans certains cas où
l’exposition aux rayons est désirée (par exemple, dans des cas de vitiligo).
L'épiderme au niveau des paupières bloque le passage des rayons UVA et UVB54.
Durant les 24 heures suivant l'ingestion des psoralènes
Le patient
doit porter des lunettes enveloppantes et opaques aux UVA s'il doit
s'exposer à la lumière du jour, et ce, même s’il s’agit de la lumière
passant à travers la vitre d'une fenêtre.
Verres de contact anti-UV.
Certains
dermatologues permettent à leurs patients de porter des lentilles cornéennes
anti-UV durant les séances de
PuvA (ex:
PermaflexMD UV par CooperVision). Ces lentilles bloquent jusqu’à
97% des rayons UV. Toutefois, l’on recommande aussi de porter des lunettes
de soleil anti-UV à l'extérieur.
Une
protection des yeux s’impose lorsque le bain PUVA est destiné à traiter tout
le corps. Il n’est pas nécessaire de se protéger les yeux si
le traitement se limite aux
mains et / ou aux pieds.
Lorsque le
corps entier est immergé dans le bain-PUVA
(à la concentration habituelle
de 1.87 mg/l de 8-MOP) pour 30 minutes, le niveau sanguin du 8-MOP
atteint 4.8 ng/ml 60 minutes après le bain. En comparaison, lors de la prise
de 8-MOP par voie orale, le
niveau sanguin du 8-MOP s’élève à
108.87 ng/ml une heure et demie après la prise du médicament.
La protection de la peau
La journée du traitement
Il faut éviter de s'exposer au soleil.
Si l’on doit absolument le faire, il faudrait employer un
écran solaire et porter des vêtements appropriés. On doit également éviter
les bains de soleil 24 heures avant le traitement et 48 heures après. De
plus, il faut éviter de se mettre du parfum et des produits parfumés.
Durant les séances de PUVAthérapie.
Il est
fortement recommandé de se couvrir le visage
Les hommes doivent protéger leurs organes génitaux par un suspensoir (athletic supporter), car ces organes sont plus susceptibles d’être atteints du cancer de la peau55
Les effets secondaires de la PUVAthérapie
Les effets aigus.
Les nausées et les vomissements
peuvent être évités si les
médicaments sont pris avec un repas ou dans un intervalle de 10 à 30
minutes. Parfois, on administre des antiémétiques pour prévenir ces effets
secondaires. On peut aussi administrer les psoralènes sous forme de suppositoire56,
que certaines
pharmacies peuvent préparer. Les céphalées, les étourdissements et
l’hypertrichose faciale sont des effets secondaires rares. De plus, un cas
de dermite de contact allergique a été rapporté.
La phototoxicité.
Le pic
d’érythème induit par la PUVA survient après 48 à 76 heures. Celui des
rayons UVB survient après 24 heures.
La photo-onycholyse,
des bulles de
friction et même une éruption psoriasiforme ont été rapportés lors de la
photothérapie. Après un arrêt du traitement pendant quelques semaines, la
plupart des patients sont aptes à le reprendre.
Le prurit
peut aussi
survenir à cause des rayons qui assèchent la peau. Un prurit particulier,
localisé sur le dos (PUVA itch), survient rarement. Ce type de prurit est
difficile à contrôler.
Les effets chroniques.
Le photovieillissement
les lentigos multiples sur les zones exposées et le cancer sont des risques à envisager.
L’épithélioma.
Les données les plus
intéressantes à ce sujet proviennent d’une étude cohorte américaine
(1975-1976), comprenant 1380 patients appartenant à 16 centres
universitaires. Robert Stern
était désigné comme le coordonnateur57,58
L’étude a
révélé une incidence d’épithélioma spinocellulaire 11 fois plus élevée
lorsque des doses importantes ont été accumulées ou quand le nombre de
traitements a été excessivement élevé. Cette étude a aussi démontré qu’il
n’y avait pas d’incidence élevée d’épithélioma basocellulaire, mais qu’il y
avait une incidence élevée de tumeurs génitales. Les études européennes
n’ont pas confirmé cette constatation. Le risque augmentait avec l’ingestion
d’arsénic, la radiation ionisante ou la prise de Méthotrexate.
En 1991, une étude a été effectuée en Suède59 auprès de 5000 patients, lors d’un suivi de 6.9 ans pour les hommes et de 7.2 ans pour les femmes. Dans cette étude, on a décelé une incidence 6 fois plus élevée d’épithélioma spinocellulaire chez les hommes et 5 fois chez plus élevée chez les femmes. Lorsque le nombre de séances de PUVA s’élevait à plus de 200, le risque de souffrir d’épithélioma spinocellulaire augmentait considérablement. On n’a pas constaté de cas de mélanome dans cette étude, mais il faut dire que la durée de suivi n’était que de 8 ans.
Lorsque la
dose cumulative de rayons UVA s’élève à plus de 1500 J que le nombre de
séances se chiffre à plus de 200, il y a assurément un risque élevé de
souffrir d’épithélioma spinocellulaire
Les tumeurs génitales.
Une autre étude effectuée
auprès de 3200 patients n’a pas mis en évidence, au cours des deux dernières
décennies, de cas de tumeur génitale au scrotum. Il semble que le
papillomavirus soit impliqué dans le développement de tumeurs génitales, et
que la PUVA favorise ce processus60
Les mélanomes.
Dans une autre étude
européenne, impliquant 1600 patients lors d’un suivi de 8 ans, on n’a pas
décelé de cas de mélanome, sauf chez les patients ayant des antécédents de
prise de méthotrexate ou de traitement à l’arsenic ou aux radiations
ionisantes61
Le mélanome est un effet
secondaire qui n’a été observé que récemment par Stern17.
L’étude s’est basée sur le même groupe cohorte
de 1380 patients de l’étude américaine. On vient de mettre en évidence que
durant les 15 premières années (1975 à 1990) on a découvert 4 cas de
mélanomes. Ce nombre est comparable à ce que l’on retrouve dans la
population générale. L’on a conclu qu’il n’y avait pas eu d’incidence élevée
de mélanomes durant ces 15 premières années de suivi. Par contre, durant les
années suivantes, c’est à dire de 1991 à 1996 on a décelé 7 cas additionnels chez ce même
groupe. Cette découverte signifie que le risque de développer un mélanome
est 5 fois plus élevé chez les patients recevant une PUVAthérapie que chez
la population en général.
En 1998,
durant le congrès de photo-médecine à Orlando, Stern a fait une mise à jour
sur le suivi de ses patients durant l’année 1997. Quatre nouveaux cas de
mélanomes se sont ajoutés à la liste, ce qui veut dire que 11 cas de
mélanomes se sont développés depuis 1991. Ce taux est nettement supérieur à
la moyenne.
Le risque
pour cette période était 3,8 fois plus élevé que celui de la période allant
de 1975 à 1990. Il est également 3,1 fois plus élevé chez les patients qui
ont reçu plus de 250 traitements.
Deux des
patients atteints de mélanomes sont décédés de métastases. Il est important
de souligner que la dernière séance de PUVA a eu lieu au moins cinq ans
auparavant, ce qui signifie que le processus de développement du mélanome
est lent et peut se poursuivre bien longtemps après l’arrêt de la
puvathérapie.
Il faut aussi ajouter que 3
des 11 mélanomes ont été décelés chez un même patient, ce qui laisse
supposer la possibilité d’un syndrome pré-néoplasique familial62.
Lorsque la base de données a été mise sur pied au début de l’étude (1974),
ce syndrome de mélanome familial précurseur n’avait pas encore été rapporté.
Ce patient atteint de trois mélanomes serait-il porteur de ce syndrome? on
ne pourrait confirmer ou infirmer ce fait.
Les effets secondaires oculaires. L’assiduité des patients à porter les lunettes de protection lors de la PUVAthérapie est variable63
.
Une étude de suivi de 10 ans effectuée auprès
de patients qui se sont protégés les yeux au cours de leur PUVAthérapie n’a
pas mis en évidence un risque élevé de souffrir d’anomalies du cristallin ou
de cataractes.
Une autre étude de suivi qui a duré deux à quatre ans, a été menée auprès de
949 patients qui avaient négligé de se protéger les yeux au cours de leur
photothérapie. Elle n’a pas démontré de risque élevé d’opacité du
cristallin. Par contre, on a révélé une incidence élevée d’hyperhémie
conjonctivale et de diminution de la lacrymation par rapport à celle du 749
patients qui ont suivi les recommandations de protection oculaire. On peut
donc conclure que la PUVAthérapie ne semble pas induire d’opacité du
cristallin64.
Les effets secondaires
immunologiques. Sont
caractérisés par un effet de suppression des cellules T auxilliaires,
(T-helper), T suppressives (T-suppressor), polymorphonucléaires monocytes,
macrophages et dendritiques.
Les avantages de la puvathérapie :
Dans le cas du psoriasis,
95% des patients obtiennent un blanchiment en 30 séances. Lors d’une étude
récente où l’efficacité de cinq modes de traitements – soit la photothérapie
aux rayons UVB, la PUVAthérapie, le méthotrexate, les rétinoïdes et la
cyclosporine – a été comparée, la PUVAthérapie s’est révélée la plus
efficace, suivie par la photothérapie aux rayons UVB et l’utilisation de la
cyclosporine. Le taux de blanchiment obtenu avec l’utilisation des
rétinoïdes et de la cyclosporine était inférieur. On n’a pas tenu compte du
méthotrexate, car ce médicament n’est utilisé présentement que dans les cas
de psoriasis grave65.
Si l’on compare la
PUVAthérapie comme traitement systémique avec d’autres agents systémiques
comme le méthotrexate, l'étrétinate, la cyclosporine et l'hydroxyurée, l’on
constate que la PUVAthérapie ne met pas en danger la vie du patient et
qu’elle est considérée, comme un traitement systémique de premier choix. En
effet, le méthotrexate peut causer une toxicité au niveau de la moelle
osseuse à court terme et une toxicité hépatique à long terme66.
L'étrétinate était un médicament tératogène et il pouvait causer des
anomalies osseuses, tandis que
l’utilisation de la cyclosporine demande une surveillance constante de la
fonction rénale67.
Le psoriasis
en plaques épaisses répond mieux à la PUVAthérapie qu'à la photothérapie aux
UVB parce que les rayons UVA sont plus pénétrant. Il en est de même pour le
psoriasis des ongles.
L’administration de la PUVAthérapie n’a pas été associée à des maladies
cardio-vasculaires, à des néoplasmes non cutanés ou des effets tératogènes.
Conclusion :
La
photothérapie demeure , malgré tout, un outil important dans l’arsenal
thérapeutique en dermatologie. La liste des maladies qui répondent à cette
modalité ne cesse de grandir de jour en jour. Les effets secondaires à long
terme, comme le mélanome, doivent nous inciter à limiter les doses
cumulatives de rayons UVA, surtout chez les jeunes personnes et chez celles
ayant un phototype de peau I ou II. Avant d’abandonner la PUVAthérapie au
profit de nouvelles technologies, il faudrait s’assurer de leur innocuité.
Références
1.
Kloth LC. Physical modalities in wound
management: UVC, therapeutic heating and electrical stimulation. [Review].
Ostomy Wound Management 1995 Jun;41(5):18-20, 22-4, 26-7.
2.
Rampen FHJ, Fleuren BAM, de Boo ThM, et al:
Unreliability of self-reported burning tendencies and tanning ability. Arch
Dermatol 1988;124:885-888
3.
Alsins J; Juhlin L; Fischer T; Claesson S.
Development of narrow-band lamps for testing and clinical use.
Strahlentherapie 1977;153:61-4
4.
Parrish JA, Jaenicke KF. Action spectrum of phototherapy of psoriasis.
J Invest Dermatol. 1981;76:359-362
5.
van Weelden H. De La Faille HV.
Young E. van der Leun JC. A new development in
UVB phototherapy of psoriasis. Br J Dermatol. 1988:119:11-19
6.
Green C.
7.
Picot E, Picot-Debeze MC, Meunier L, Peyron JL, Meynadier J. [Narrow-band
UVB phototherapy (Philips TL01 lamps) in psoriasis].[French].
Annales de Dermatologie et de Venereologie
1992;119(9):639-42.
8.
George SA, Bilsland DJ, Johnson BE, Ferguson
J, Narrow-band (TL-01) UVB air-conditioned phototherapy for chronic severe
adult atopic dermatitis. British Journal of Dermatology 1993
Jan;128(1):49-56
9.
An appraisal of narrowband (TL-01) UVB
phototherapy. British Photodermatology Group Workshop Report (April 1996)
British Journal of Dermatology 1997:137:327-330
10.
Coven TR. Burack LH, Gilleaudeau P. Keogh M. Ozawa M. Krueger
JG. Narrowband UV-B produces supenior clinical and histopathological
resolution ot moderate-tosevere psoriasis in patients compared with broadband UVB. Arch Dermatol 1997:133:15141522
11.
Jeanmougin M. Photothérapie et rétinoïdes dans le traitement des
psoriasis.
Nouv Dermatol 1992;11:455-462
12.
Stern RS. Narrowband UVB and Psoriasis
(Editorial). Arch Dermatol 1997:133:1587-1588
13.
Green C. Laksnmipathi T, Johnson BE,
14.
FlindtHansen H, McFadden N, Larsen TE, EegLarsen T, Thune P. Effect of new narrowband, UVB lamp on photocarcinogenesis in mice. Acta Derm Venereol.
1991:71:245248
15.
Gibbs NK.
16.
Stern RS; Laird N. The carcinogenic risk of
treatments for severe psoriasis. Photochemotherapy Follow-up Study. Cancer
1994;73:2759-64
17.
Stern RS. Nichols KT, Väkevä LH. Malignant
melanoma in patients treated for psoriasis with methoxsalen (psoralen) and
ultraviolet A radiation (PUVA): the PUVA Follow-up Study. N Eng J Med.
1997:336:1041-1045.
18.
Consensus Guidelines on the Use of UVB in
Combination with Calcipotriol for the Treatment of Psoriasis. "The Chronicle
of Skin and Allergy" Février 98; p.13
19.
Benohanian A, Gilbert M, Québec,
Ramsay C, et Schwartz BE, Les Laboratoires Leo Canada Ltée L’association
calcipotriol-uvbthérapie à 2 séances / semaine: un traitement sécuritaire,
efficace qui nécessite une dose moindre d'uvb pour blanchir le psoriasis. Affiche; 2e congrès de l’Association
des dermatologistes du Québec
20.
Eells LD, Wolff JM, Garloff J, Eaglstein WH.
Comparison of suberythemogenic and maximally aggressive ultraviolet B
therapy for psoriasis. J Am Acad Dermatol. 1984;11:105-10.
21.
Walters IB, Burack LH, Coven TR, Gilleaudeau
P, Krueger JG. Suberythemogenic narrow-band UVB is markedly more effective
than conventional UVB in treatment of psoriasis vulgaris. J Am Acad
Dermatol. 1999;40:893-900.
22.
Tanew A, Ortel B, Honigsmann H. Half-side
comparison of erythemogenic versus suberythemogenic UVA doses in oral
photochemotherapy of psoriasis. J Am Acad Dermatol. 1999;41:408-13
23.
Oikarinen A, Peltonen J, Kallioinen M.
Ultraviolet radiation in skin ageing and carcinogenesis: the role of
retinoids for treatment and prevention. [Review]. Annals of Medicine
1991;23(5):497-505
24.
Thomson ML. Relative efficiency of pigment and
horny layer thickness in protecting the skin of Europeans and Africans
against solar ultraviolet radiation. J Physiol 1955; 127:236-46
25.
Weigand DA, Haygood C, Gaylor JR. Cell layers
and density of negro and Caucasian stratum corneum. J Invest Dermatol
1974;62:563-8.
26.
Fahmy IR, Abu-Shady H. A crystalline principle
from Ammi majus L. Nature 1947;160 :468-9.
27.
Fahmy IR, Abu-Shady H. Ammi majus Linn. Pharmacological study and isolation
of crystalline constituent, ammoidin.
Q J Pharm Pharmacol 1947;20 :281
28.
El Mofty AM. Vitiligo & Psoralens. 1968. Pergamon Press.
29.
Pathak MA, Fitzpatrick TB. The evolution of
photochemotherapy with psoralens and UVA (PUVA): 2000 BC to 1992 AD. J
Photochem Photobiol B. 1992;14:3-22.
30.
Musajo, L. and Rodighiero, G : Photophysiology. Volume VII,
Academic Press,
31.
Mortazani S, Oberste-Lehn HI. Lichtsensibilisatoren und ihre therapeutischen
fahigkeitein.
Z Hautkr Geschlechtskr, 1973, 43 :1-7
32.
Parrish J., Fitzpatrick T., Tanenbaum L.,
Pathak M. Photochemotherapy of psoriasis with oral methoxsalen and longwave
ultraviolet light. N Engl J Med 1974;291: 1207-1211
33.
30
Thomas P
Thérapeutique dermatologique. Louis Dubertret. Médecine-Sciences Flammarion
p 896-898.1991.
34.
Berg M; Ros AM. Treatment of psoriasis with
psoralens and ultraviolet A. A double-blind comparison of 8-methoxypsoralen
and 5-methoxypsoralen. Photodermatol Photoimmunol Photomed 1994;10:217-20.
35.
Kovacs SO. Vitiligo. J Am Acad Dermatol.
1998;38:647-66..
36.
Larko O. Phototherapy of
eczema. Photodermatol Photoimmunnol Photomed.1996;12 :91-4
37.
Yoshimura M, Namura S, Akamatsu
H, Horio T. Antimicrobial effects of phototherapy and photochemotherapy in
vivo and in vitro. Br J Dermatol.1996;135:528-532
38.
Brucke J, Tanew A, Ortel B, Honigsmann H.
Relative efficacy of 335 and 365 nm radiation in photochemotherapy of
psoriasis. British Journal of Dermatology 1991 Apr;124(4):372-4
39.
Farr PM,
Diffey BL, Higgins EM, Matthews JN. The action spectrum between 320
and 400 nm for clearance of psoriasis by psoralen photochemotherapy. British
Journal of Dermatology 1991 May;124(5):443-8.
40.
Diepgen T, Niedner R, Kapp A, Schopf E.
High-dose UVA1 therapy in the treatment of patients with atopic dermatitis.
J Am Acad Dermatol 1992;26:225-30
41.
Krutmann J,
Schopf E. High-dose-UVA1 phototherapy: a novel and highly effective
approach for the treatment of acute exacerbation of atopic
dermatitis.[Review]. Acta Dermato-Venereologica. Supplementum 1992;176:120-2
42.
Kerscher M; Volkenandt M; Gruss C; Reuther T;
von Kobyletzki G; Freitag M; Dirschka T; Altmeyer P. Low-dose UVA phototherapy for
treatment of localized scleroderma. J Am Acad Dermatol 1998;38:21-6
43.
Henseler T; Wolff K; Honigsmann H;
Christophers E. Oral 8-methoxypsoralen photochemotherapy of psoriasis. The
European PUVA study: a cooperative study among 18 European centres. Lancet
1981;18:853-7.
44.
Kerscher M, Gruss C, von Kobyletzki G,
Volkenandt M, Neumann NJ, Altmeyer P, et al. Time course of 8-MOP-induced
skin photosensitisation in PUVA bath photochemotherapy. Br J Dermatol
1997;136:473-4.
45.
Gruss C, Behrens S, Reuther T, Husebo L,
Neumann N, Altmeyer P, Lehman P, Kerscher M. Kinetics of photosensitivity in
bath-PUVA photochemotherapy. J Am Acad Dermatol 1998;39 :443-6.
46.
Pai S., Srinivas CR. Bathing suit delivery of
8-methoxypsoralen for psoriasis: a double-blind, placebo-controlled study.
Int J Dermatol 1994;33(8):576-8
47.
Lebwohl M; Hecker D; Martinez J; Sapadin A;
Patel B. Interactions between calcipotriene and ultraviolet light. J Am Acad
Dermatol 1997;37:93-5
48.
Koo J, Calcipotriol/calcipotriene
(Dovonex/Daivonex) in combination with phototherapy: a review. J Am Acad
Dermatol 1997;37:S59-61
49.
Anstey A, Hawk JL. Isotretinoin-PUVA in women
with psoriasis. Br J Dermatol 1997;136:798-9
50.
51.
Petzelbauer P; Honigsmann H; Langer K; Anegg
B; Strohal R; Tanew A; Wolff K . Cyclosporin A in combination with
photochemotherapy (PUVA) in the treatment of psoriasis. Br J Dermatol
1990;123:641-7
52.
Gardeazabal J; Arregui MA; Gil N; Landa N; Raton JA; Diaz-Perez
JL.
Successful treatment of musk ketone-induced
chronic actinic dermatitis with cyclosporine and PUVA. J Am Acad Dermatol
1992 ;27:838-42
53.
Kuzel TM; Gilyon K; Springer E; Variakojis D;
Kaul K; Bunn PA Jr; Evans L; Roenigk HH Jr; Rosen ST. Interferon alfa-2a
combined with phototherapy in the treatment of cutaneous T-cell lymphoma. J
Natl Cancer Inst 1990;82:203-7
54.
Prystowsky JH; Keen MS; Rabinowitz AD; Stevens AW;
55.
de la Brassinne M, Richert B.
Genital squamous-cell carcinoma after PUVA
therapy. Dermatology 1992;185(4):316-8.
56.
Bologna JL, Freije L, Amici Louis,
Dellostritto J, Gasparro FP. Rectal suppositories of 8-methoxsalen produce
fewer gastrointestinal side effects than oral formulation. J Am Acad
Dermatol 1996;35:424-7
57.
Stern RS. Risks of cancer associated with
long-term exposure to PUVA in humans: current status1991 . Blood
Cells.1992;18:91-7
58.
Stern RS, Laird N. The carcinogenic risk ot treatments tor
severe psoriasis: Photochemotherapy Follow-up Study. Cancer. 1994:73:27592764.
59.
Lindelof B; Sigurgeirsson B; Tegner E; Larko
O; Johannesson A; Berne B; Christensen OB; Andersson T; Torngren M; Molin L;
et al. PUVA and cancer: a large-scale epidemiological study [see comments]
Lancet 1991;338:91-3
60.
Weinstock MA; Coulter S; Bates J; Bogaars HA;
61.
Henseler T; Christophers E; Honigsmann H;
Wolff K. Skin tumors in the European PUVA Study. Eight-year follow-up of
1,643 patients treated with PUVA for psoriasis. J Am Acad Dermatol
1987;16:108-16.
62.
Reimer RR, Clark WH Jr, Greene MH, et al.
Precursor lesions in familial melanoma: a new genetic preneoplastic
syndrome. JAMA 1978;239:744-6
63.
Benohanian A. Eye protection compliance in
PUVA treated patients. Canadian
Dermatology Association Journal 1986;1(5):4-5
64.
Calzavara-Pinton PG; Carlino A; Manfredi E;
Semeraro F; Zane C; De Panfilis G: Ocular side effects of PUVA-treated
patients refusing eye sun protection. Acta Derm Venereol Suppl (Stockh)
1994;186:164-5
65.
Spuls PI, Witkamp L, Bossuyt PMM, Bos JD. A
systematic review of five systemic treatments for severe psoriasis. Br J
Dermatol 1998; 137:943-949
66.
West SG. Methotrexate hepatotoxicity. Rheum
Dis Clin North Am 1997;23:883-915.
67.